质谱检测法如何进行蛋白质分析?
MS/MS操作模式
串联质谱仪通常使用的都是离子模式来鉴定蛋白质的氨基酸序列。目前所有的MS/MS质谱仪都具有该功能。不过其它特殊的质谱仪也具有MS/MS功能。如果要发现蛋白质中的某个功能基团则需要用到母离子扫描功能或者中性丢失扫描功能,而这就必须用到三重四级杆质谱仪,如Q-Q-Q质谱仪,或四级杆离子阱质谱仪,如Q-Q-LIT质谱仪。比如复杂混合物里的蛋白质磷酸化位点和糖基化位点就都可以用这种方法(在碰撞池中产生特殊的报告离子,通过它来进行特殊的功能检测)检测出来。在一个典型的质谱检测试验中,首先先用母离子扫描或中性丢失扫描都能发现目标组分,然后再用传统的MS/MS方法鉴定蛋白质的氨基酸序列以及定位修饰位点。
三重四级杆质谱仪在MRM模式下也能以*的敏感度进行定量分析。已知的或未知的分析物都以*的敏感度和选择性能被定量检测出来。这种高选择性得益于质谱仪能够对代表一个肽段的一对母离子和片段裂解物离子进行实时监测。而且,在MRM模式下进行的两轮选择过程会极大地提高检测的灵敏度,因为第①轮筛选过后只能剩下很少的离子,这也就将背景噪声减小到了zui低水平。碰撞诱导解离片段离子(collision-induced dissociation fragment ions, CID)来源于母离子,这些CID离子能够产生离散信号,而背景化学噪声信号则是随机分布的。zui后,由于这种采样时间很长的技术固有的非扫描本质使得它的敏感度非常高,相比离子扫描技术的探测极限(LOD)要高出好几个数量级。
质谱仪的性能
总体来说,质谱仪的性能包括分辨率、敏感度或探测极限和准确性等,这些性能都与质谱仪的类型、采用的离子化方法和扫描能力有关。不过没有哪一个仪器能同时在上述所有方面都全面占优,在选择仪器的时候必须根据实验需要进行相应的取舍。
对实验仪器性能的比较一直以来都是一个存在很多争议的话题。因为性能是服务于需求的,是取决于待测样品和实验步骤的。质谱仪对单独肽段样品进行检测时敏感度总是很低,不过如果生物样品的基质背景(matrix background)很高,那么检测的敏感度就会提高好几个数量级。这种同一款仪器在性能上表现出来的“不稳定性”其实很常见,在仪器处于不同操作条件或状态下时(比如在*条件下,常规条件下和大批量处理条件下)它们的性能表现都是不同的。实验目的是想进行定量分析还是蛋白质鉴定,这也决定了该使用哪种仪器。在蛋白质鉴定试验中,仪器的分辨率(能很好地区分不同组分)和准确性是zui主要的,而在定量研究中,敏感度、动态范围和MRM能力才是zui主要的。因此,我们应该根据实验目的的需要以及实验设计安排来确定该使用哪种质谱仪。
要想用全扫描模式(full scanmode)获取定量数据的同时再用MS/MS模式获取定性数据是一件非常困难的事情。不过某些“杂交”质谱仪,比如LIT-ICR质谱仪,由于它们能够平行采集数据,因此可以部分解决上面那个问题。精确的定量分析需要源自整个洗脱图(entire elution profile)的高质量的、高信噪比的数据信息。数据质量与数据采集参数高度相关,这些数据采集参数包括扫描时间或者采样时间(对于非扫描质谱仪而言)。因此,我们经常需要在数据质量和样品处理能力(量)之间做出取舍。
zui新进展
zui近又有几项有关质谱仪的进展问世,这些新成果的出现又给我们的生物大分子研究工作补充了“弹药”。在蛋白质测序方面,基于碰撞诱导裂解技术(CID),又新出现了可变裂解技术(Alternate fragmentationtechnique),该新技术是基于处在碰撞池中的离子具有的电子传递特性开发出来的。目前,电子捕获解离技术(ECD)和电子传递解离技术(ETD)都已经分别被应用到FT-ICR质谱仪和LIT质谱仪上了。运用这两种技术产生的蛋白质裂解产物能与经典的CID方法裂解产物互为补充。不过这两种新方法裂解更均匀,更适合用于发现翻译后修饰情况。ECD技术和ETD技术还都可以用于大型肽段和蛋白质的研究。他们的裂解能力和对完整蛋白的分析能力可以帮助我们直接用质谱仪对完整的蛋白质进行分析,即可以采用所谓的“自上而下(top-down)”的方法进行研究。这样,我们能够获得完整的氨基酸序列信息和翻译后修饰信息,能够对蛋白质进行zui准确的鉴定。
传统的和的蛋白质组学研究策略
虽然到目前为止,还没有一种蛋白质组学研究策略能够对某个蛋白质组进行常规的、完整的分析,但是现在的技术已经非常强大,我们相信,很快就能进行全蛋白质组学研究了。而且,对某个亚蛋白质组(比如某个细胞器或亚细胞结构的蛋白质组)进行研究早就已经不是什么难题了,这已经成为了一种常规的研究手段。不过,蛋白质组学研究方法也需要视研究目的而做出相应的调整,不能千篇一律。比如有很多研究都是描述性的研究项目,主要的关注点都着眼在发现、鉴定出蛋白质以及这些蛋白质的翻译后修饰情况,而zui近又开始逐渐兴起蛋白质组学定量研究了。
实际上,每一个以质谱检测为基础的蛋白质组学研究工作都包括以下3大部分:(i)分离、消化蛋白质样品,然后对样品进行进一步裂解;(ii)对样品进行质谱定性和定量检测;(iii)用相应的软件对质谱检测结果进行分析处理,获得蛋白质的氨基酸序列,并且如果可能的话,进行定量分析。蛋白质的鉴定工作主要由MS/MS质谱仪负责,然后通过将质谱检测结果与数据库中的数据进行比对,zui后确定出蛋白质的氨基酸序列。需要提醒的是,对结果的统计分析工作是保证结果正确性的关键。
对纯化蛋白进行质谱分析
下面,我们用zui“古老”的蛋白质组学研究方法——2维凝胶电泳法(two-dimensional gel electrophoresis, 2DE)结合质谱分析法对纯化蛋白进行质谱分析的策略为例进行介绍(图2A)。首先,待测目标蛋白经消化、酶解之后经由质谱仪进行鉴定,通常使用的都是MALDI-ToF质谱仪来获取肽链指纹图谱(peptide mass fingerprint)。zui近,出现了好几种该策略的改进方法,即将各种连续电泳分离方法(sequential electrophoretic separation method)或色谱分离方法(chromatographic separation method)结合进来,以提高质谱检测时的峰容量,这样就提高了对复杂样品的分辨率。定量分析则是在蛋白质水平通过比较不同样品中目标蛋白的信号强度来完成的。这种策略的优劣取决于它们区分相关(近)蛋白质的能力,即分辨率的高低,比如要能够区分出经不同类型修饰的蛋白质,还取决于待测样品的复杂程度。这种研究策略zui大的问题是动态范围太窄,而且处理样品的能力也不够高,不具备高通量分析的功能,因此不足以进行蛋白质组学研究。而且,一些比较重要的蛋白质,比如膜蛋白等还不能用该方法进行分析,因为该方法只能用于分析复杂度比较低的样品,或者用于对某一特定蛋白进行分析的实验。
对复杂样品进行质谱检测
对复杂样品进行质谱检测时也用到了人类基因组研究项目中用到的“niao枪法”策略。即首先将蛋白质组样品进行裂解,这样获得的多肽片段才能够用于自动化MS/MS分析,我们常用的是快速扫描设备如IT质谱仪(图2B)。用这种方法可以对完整细胞裂解物或组织提取物进行分析,也可以对亚细胞结构、提纯的细胞器或其它亚蛋白质组样品进行检测。
如果给待测样品带上稳定的同位素标记,我们就可以对样品中不同蛋白质的丰度进行检测了,这些蛋白质可能在化学性质方面是一样的,但是我们可以通过不同的同位素信号强度比对它们进行区分(图3A)。也可以使用如图3B中所示的串联标记(tandem mass tag)方法对样品进行多次质谱分析。还可以在进行质谱分析之前往待测样品中添加定量的同位素标记肽段,以获得样品准确的定量数据(图3C)。
这种“niao枪法”zui大的优势就是简单,不论从理论层面来说还是从实验操作层面来说都很简单,该方法相比前面所述的各种方法能够对蛋白质组分进行更大程度的覆盖,同时定量的准确性更高。不过该方法也有其局限性,具体表现在动态范围不够,难以使用生物信息学方法从大量的、高冗余的、复杂的蛋白质组样品质谱数据中推断出蛋白质序列。幸好这些问题已经部分得到了解决,通过裂解的方法可以降低样品的复杂程度。常用的裂解方法主要针对的都是蛋白质组中生物信息学资料丰富的部分,比如富含半胱氨酸的肽段、磷酸化的肽段、糖基化的肽段等等。这种“niao枪法”策略用于快速鉴定复杂样品中的组分,也非常适合用于对不同样品中同一蛋白质的定量比较研究。在“niao枪法”策略中,在蛋白质水解过程里,不同肽段间的联系信息以及肽段与其来源蛋白质间的联系信息都已经丢失了,因此该方法不太适合用于对具有多重修饰的蛋白质进行鉴定工作。
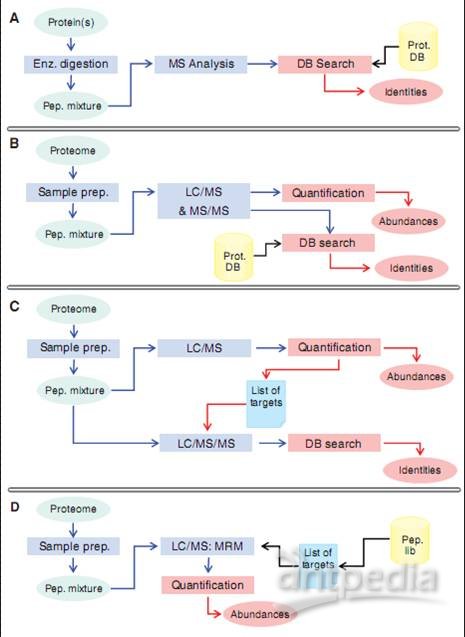
蛋白质组学研究策略示意图
Protein(s):待测蛋白质样品;Enz. Digestion:酶解;Pep.Mixture:裂解产物混合物;
MS Analysis:质谱检测分析;DB Search:数据库比对搜索;Identities:鉴定;
Prot.DB :蛋白质数据库;Proteome:蛋白质组;Sample prep:样品准备(裂解);
LC/MS& MS/MS:LC/MS以及 MS/MS分析;Quantification:定量研究;
Abundances:丰度;List of targets:挑选出待测样品;Pep.lib:待测靶样品;
图2 蛋白质组学研究策略示意图。A:经由2维电泳或pull-down实验发现的待测蛋白质样品prot随即被酶解,然后用质谱仪对酶解片段pep进行质谱检测分析。zui后根据肽质指纹图谱(PMF)鉴定出肽段以及它们的来源蛋白。其它的MS/MS数据也能用来进行肽段鉴定。B:随机蛋白质鉴定和定量分析方法,即niao枪法。该方法可以对样品同时进行鉴定以及定量研究。被选出的肽段如图1A中所示,经过串联质谱仪进行离子扫描分析。在这里,母离子是被随机选出的,通常母离子的裂解片段中只有一个片段能够被检测到,也就是说存在采样不足的问题。MS1质谱仪采集到的离子强度信息与参考分子信息比对可以进行定量分析,这里使用的参考分子通常都会标记上稳定的同位素标签。C:定量研究方法能去除蛋白质定量研究与鉴定过程中的干扰信号。首先,MS1质谱仪会通过比对不同样品的肽模式,即肽段分子量相对色谱保留时间作图的结果,挑选出不同样品间丰度不同的肽段。然后被挑出的肽段进入下一轮MS/MS质谱检测。D:基于各种假说的检测方法。该方法可以对各种预先被设定肽段的丰度进行高精度的检测,我们通常都是根据以往的实验结果来挑选这些靶肽段。在这里常用的方法是图1D中所示的MRM方法。如果在试验中选用合适的参考肽段会进一步提高实验的准确性。
比较模式分析
图2C中所示的比较模式分析法其实在原理上与2维电泳方法是相似的,就像在2维电泳中一样,每一个蛋白质都是一个独立的点,可以借此对它们进行定量和定性的分析。而且还可以进一步对蛋白质进行分析,比如进行蛋白质测序或进行翻译后修饰情况鉴定等。不过在以质谱检测手段为基础的分析方法中,蛋白质样品首先需要被降解、片段化,然后再用液相色谱-质谱仪LC/MS进行分析。借助色谱洗脱时间和分子量这两个参数,我们就可以鉴定出一个多肽离子。将所有离子的数量信息整合起来就得到了蛋白质的定量信息。这种方法主要的优势在于它可以对质谱仪发现的所有信息进行定量处理。与“niao枪法”相比这是非常明显的优势,因为在“niao枪法”里,只能对被鉴定出来的肽段进行定量化处理。不过在实际运用过程中,这种比较模式分析方法的重复性很差,也没有非常好的配套软件对检测结果进行分析。用这种方法可以获得一些数据,根据这些数据能够推测出蛋白质序列,这些数据包括质荷比(m/z)、带电荷状态、洗脱时间以及离子强度等。需要被测序的多肽(比如在两个样品中表达丰度不同的同一蛋白质)会出现在检测结果列表中,然后,我们会将该蛋白(多肽)进行新一轮的直接质谱检测,专门只采集它的MS/MS质谱图信息。这种研究方法也可用于MALDI/MS/MS质谱检测平台,因为蛋白质样品都被“固定”在样品板上,因此可以对它们进行不受时间限制的连续检测。
基于各种假说的研究策略
随着各种质谱仪技术的不断进步,我们有理由相信会出现敏感度更高、处理速度更快、更可靠的蛋白质组研究设备。不过目前我们还不清楚这些技术上的进步是否足以突破当下蛋白质组学研究工作中的瓶颈。以前我们曾认为蛋白质组学研究策略需要进行有效的变革才能全面、有力的对蛋白质组进行研究和分析。这种变革的核心就是改变以往那种在每一次试验中都对既往结果进行重复研究的蛋白质组学研究方法,新的研究策略是根据既往的研究成果来设计、指导进行新的实验研究项目。我们预计与人类基因组计划一样,将来也会获得某个物种的完整蛋白质组序列图谱,未来蛋白质组的研究目标应该是对蛋白质(多肽)进行具有特定目的的、非冗余的分析研究。对于质谱技术和质谱仪器的发展来说,这种研究策略的转变需要有更好的检测设备和检测手段(流程)做依托,要能够以更快的速度、更高的灵敏度和更强大的分析能力进行质谱检测。现在也出现了可供序列组装、修饰情况查询的数据库。可以预计,在不久的将来,各种生物学假说将会给我们设定出许多待检测的蛋白质靶标。我们可以将这些蛋白质的信息录入数据库,构成一个检测这些假说所必需的极小集蛋白质信息簇。然后,可以用各种方法,比如MRM方法对这些蛋白质进行检测(图2D)。因为这种研究方法主要是对非冗余靶标进行质谱检测,所以,在检测的敏感度方面和样品处理能力方面都有很大的提高。如果再配合定量的、标准化的同位素标记参考肽段,还可以进行精确的定量分析。
上述这种研究策略用于Q-Q-LIT质谱仪这类被我们使用了几十年,主要用于检测小分子药品和体内药物代谢研究领域的三重四级杆质谱仪。在研究药物代谢时使用的研究方法同样适用于蛋白质组学研究领域。
作为上述方法的一个补充,Smith又开发出另一种使用精确分子量标签来鉴定蛋白质的方法。该方法首先测定待测物质的分子量,然后将数据与分子量数据库进行比对,以此来鉴定蛋白质。这样就无需再对每一个样品中的每一条多肽进行测序了。随着蛋白质组学研究的不断开展,我们积累的数据也越来越多,并且数据积累的速度也越来越快,同时,各种分析软件的功能也越来越强大,因此我们相信,基于各种假说的蛋白质组学研究策略一定会被更多的人所接受,所采用。
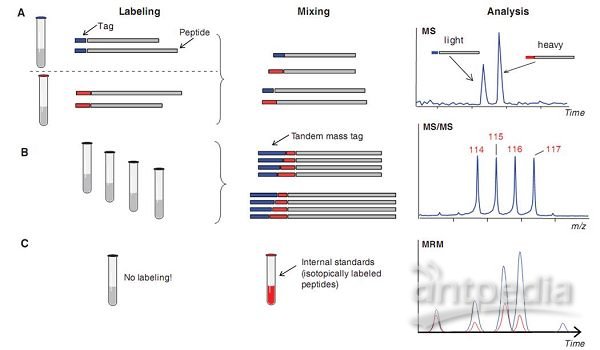
肽段定量分析策略示意图
Labeling:标记 Tag:标记物 Peptide:肽段Mixing:混合 Analysis:分析
MS:质谱检测 light:较轻的片段 heavy:较重的片段 Time:时间
Tandem mass tag:串联标签 MS/MS:MS/MS模式 m/z:质荷比
No labeling!:为标记 MRM:MRM方法
Internal standards(isotopically labeledpeptides):内参,即同位素标记的肽段
图3 肽段定量分析策略示意图。A:同位素稀释法是进行肽段定量分析时zui常用的一种方法,该方法也是进行蛋白质组学研究时常用的一个方法。该方法的原理是在一号样品所有的待测蛋白质上都带上一个稳定的同位素标签,同时在二号样品所有的待测蛋白质上都带上另一个稳定的同位素标签。这样,这两组样品就可以互为参照了。可以借助化学的方法,例如稳定的同位素编码标签试剂、代谢标记反应和酶标反应等对蛋白质进行同位素标记。B:使用串联标签进行定量研究。该方法同样需要各种稳定的同位素标记物。这些同位素标记物由两种同位素标记元素组成,它们都有固定的分子量。目前,这些试剂可用于四通道反应。通过在质谱仪的MS/MS模式下检测连接在蛋白质N端报告基团的相对强度以及CID图谱中低分子量范围里的信号可以获得待测蛋白质的定量信息。C:使用内参进行定量研究的方法。该方法实际上也是一种同位素稀释法。在该方法中会往待测样品中添加一种已知浓度的同位素标记的肽段,然后借助标准曲线进行精确的定量分析。虽然该方法样品制备过程较为复杂,但是它的前景非常光明。它非常适合用于基于各种假说的检测方法。
结论与展望
在过去的十年里,是蛋白质分析,更准确的说应该是蛋白质组学分析推动了质谱检测技术的发展。各种技术进步已经使质谱仪在准确度、分辨力、敏感度、定量分析能力等各方面都有了长足的进展,蛋白质组质谱检测策略方面也有了新突破。分析完整蛋白质、蛋白质复合体、低丰度蛋白质等各种样品的检测操作流程层出不穷。虽然这些质谱检测技术是为了满足蛋白质分析的需求而诞生的,但是它们出现之后又反过来推动了生物大分子(包括代谢产物、脂类物质、碳水化合物等等)领域的研究。因此,我们有理由相信,质谱检测技术必将在生物研究的各个领域里占有重要的一席之地。
------ 责任编辑:瑞利祥合--分析仪器采购顾问
版权所有(瑞利祥合)转载请注明出处
免责声明
- 凡本网注明“来源:化工仪器网”的所有作品,均为浙江兴旺宝明通网络有限公司-化工仪器网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其他方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:化工仪器网”。违反上述声明者,本网将追究其相关法律责任。
- 本网转载并注明自其他来源(非化工仪器网)的作品,目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。
 手机版
手机版 化工仪器网手机版
化工仪器网手机版
 化工仪器网小程序
化工仪器网小程序
 官方微信
官方微信 公众号:chem17
公众号:chem17
 扫码关注视频号
扫码关注视频号











 采购中心
采购中心